Сборник идеальных эссе по обществознанию. Сборник идеальных эссе по обществознанию Фипи впр 11 химия демоверсия
27 апреля 2017 года в первый раз прошли всероссийские проверочные работы ВПР по химии в 11 классах в режиме апробации.
Официальный сайт ВПР (СтатГрад) - vpr.statgrad.org
Варианты ВПР по химии 11 класс 2017 год
| № | Скачать ответы (критерии оценки) |
| Вариант 11 | ответы |
| Вариант 12 | ответы |
| Вариант 13 | ответы |
| Вариант 14 | ответы |
| Вариант 15 | variant 15 otvet |
| Вариант 16 | variant 16 otvet |
| Вариант 17 | variant 17 otvet |
| Вариант 18 | variant 18 otvet |
Для ознакомления с примерными вариантами работ на официальном сайте ФИПИ, размещены демонстрационные варианты с ответами и описания.
Образцы ВПР по химии 11 класс 2017 (демоверсия)
Проверочная работа включает в себя 15 заданий. На выполнение работы по химии отводится 1 час 30 минут (90 минут).
При выполнении работы разрешается использовать следующие дополнительные материалы:
– Периодическая система химических элементов Д.И. Менделеева;
– таблица растворимости солей, кислот и оснований в воде;
– электрохимический ряд напряжений металлов;
– непрограммируемый калькулятор.
Структура и содержание всероссийской проверочной работы ВПР по химии
Каждый вариант ВПР содержит 15 заданий различных типов и уровней сложности. В вариантах представлены задания различного формата.
Данные задания имеют различия по требуемой форме записи ответа. Так, например, ответом могут быть: последовательность цифр, символов; слова; формулы веществ; уравнения реакций.
В работе содержится 4 задания повышенного уровня сложности (их порядковые номера: 9, 10, 13, 14). Эти задания более сложные, так как их выполнение предполагает комплексное применение следующих умений:
– составлять уравнения реакций, подтверждающих свойства веществ и/или взаимосвязь различных классов веществ, и электронный баланс окислительно-восстановительной реакции;
Объяснять обусловленность свойств и способов получения веществ их составом и строением;
– моделировать химический эксперимент на основании его описания.
При выполнении заданий Вы можете использовать черновик. Записи в черновике проверяться и оцениваться не будут.
ВПР Всероссийская Проверочная Работа- Химия 11 класс
Пояснения к образцу всероссийской проверочной работы
При ознакомлении с образцом проверочной работы следует иметь в виду, что задания, включённые в образец, не отражают всех умений и вопросов содержания, которые будут проверяться в рамках всероссийской проверочной работы. Полный перечень элементов содержания и умений, которые могут проверяться в работе, приведены в кодификаторе элементов содержания и требований к уровню подготовки выпускников для разработки всероссийской проверочной работы по химии. Назначение образца проверочной работы заключается в том, чтобы дать представление о структуре всероссийской проверочной работы, количестве и форме заданий, уровне их сложности.
Инструкция по выполнению работы
Проверочная работа включает в себя 15 заданий. На выполнение работы по химии отводится 1 час 30 минут (90 минут).
Оформляйте ответы в тексте работы согласно инструкциям к заданиям. В случае записи неверного ответа зачеркните его и запишите рядом новый.
При выполнении работы разрешается использовать следующие дополнительные материалы:
– Периодическая система химических элементов Д.И. Менделеева;
– таблица растворимости солей, кислот и оснований в воде;
– электрохимический ряд напряжений металлов;
– непрограммируемый калькулятор.
При выполнении заданий Вы можете использовать черновик. Записи в черновике проверяться и оцениваться не будут.
Советуем выполнять задания в том порядке, в котором они даны. Для экономии времени пропускайте задание, которое не удаётся выполнить сразу, и переходите к следующему. Если после выполнения всей работы у Вас останется время, Вы сможете вернуться к пропущенным заданиям.
Баллы, полученные Вами за выполненные задания, суммируются. Постарайтесь выполнить как можно больше заданий и набрать наибольшее количество баллов.
Желаем успеха!
1. Из курса химии Вам известны следующие способы разделения смесей : отстаивание, фильтрование, дистилляция (перегонка), действие магнитом, выпаривание, кристаллизация. На рисунках 1–3 представлены примеры использования некоторых из перечисленных способов.
Какие из названных способов разделения смесей можно применить для очищения:
1) муки от попавших в неё железных опилок;
2) воды от растворённых в ней неорганических солей?
Запишите в таблицу номер рисунка и название соответствующего способа разделения смеси.
железные опилки притягиваются магнитом
при перегонке после конденсации паров воды в сосуде остаются кристаллы соли
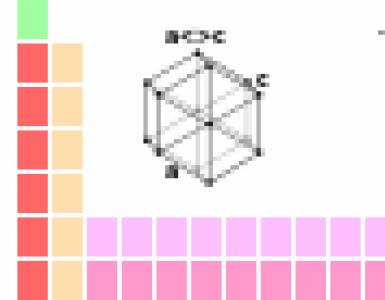
2. На рисунке изображена модель электронного строения атома некоторого химического элемента.

На основании анализа предложенной модели выполните следующие задания:
1) определите химический элемент, атом которого имеет такое электронное строение;
2) укажите номер периода и номер группы в Периодической системе химических элементов Д.И. Менделеева, в которых расположен этот элемент;
3) определите, к металлам или неметаллам относится простое вещество, которое образует этот химический элемент.
Ответы запишите в таблицу.
Ответ:
N; 2; 5 (или V); неметалл
для определения химического элемента следует посчитать общее количество электронов,которое мы видим на рисунке (7)
взяв таблицу Менделеева, мы с легкостью можем определить элемент (найденное кол-во электронов равняется атомному номеру элемента) (N- азот)
после этого определяем номер группы (вертикальный столбец) (5) и природу данного элемента (неметалл)
3. Периодическая система химических элементов Д.И. Менделеева
– богатое хранилище информации о химических элементах, их свойствах и свойствах их соединений, о закономерностях изменения этих свойств, о способах получения веществ, а также о нахождении их в природе. Так, например, известно, что с увеличением порядкового номера химического элемента в периодах радиусы атомов уменьшаются, а в группах увеличиваются.
Учитывая эти закономерности, расположите в порядке увеличения радиусов атомов следующие элементы: N, C, Al, Si. Запишите обозначения элементов в нужной последовательности.
Ответ: ____________________________
N → C → Si → Al
4. В приведённой ниже таблице перечислены характерные свойства веществ, которые имеют молекулярное и ионное строение.
Используя данную информацию, определите, какое строение имеют вещества азот N2 и поваренная соль NaCl. Запишите ответ в отведённом месте:
1) азот N2 ________________________________________________________________
2) поваренная соль NaCl ___________________________________________________
азот N2 – молекулярное строение;
поваренная соль NaCl – ионное строение
5. Сложные неорганические вещества условно можно распределять, то есть классифицировать, по четырём группам, как показано на схеме. В эту схему для каждой из четырёх групп впишите пропущенные названия групп или химические формулы веществ (по одному примеру формул), принадлежащих к данной группе.

Записаны названия групп: основания, соли;
записаны формулы веществ соответствующих групп
CaO, основания, HCl, соли
Прочитайте следующий текст и выполните задания 6–8.
В пищевой промышленности используется пищевая добавка Е526, которая представляет собой гидроксид кальция Ca(OH)2. Она находит применение при производстве: фруктовых соков, детского питания, маринованных огурцов, пищевой соли, кондитерских изделий и сладостей.
Получение гидроксида кальция в промышленном масштабе возможно путём смешивания оксида кальция с водой
, этот процесс называется гашение.
Широкое применение гидроксид кальция получил в производстве таких строительных материалов, как белила, штукатурка и гипсовые растворы. Это связано с его способностью взаимодействовать с углекислым газом CO2
, содержащимся в воздухе. Это же свойство раствора гидроксида кальция применяется для измерения количественного содержания углекислого газа в воздухе.
Полезным свойством гидроксида кальция является его способность выступать в роли флокулянта, очищающего сточные воды от взвешенных и коллоидных частиц (в том числе солей железа). Он также используется для повышения рН воды, так как природная вода содержит вещества (например, кислоты
), вызывающие коррозию в сантехнических трубах.
1. Составьте молекулярное уравнение реакции получения гидроксида кальция, которая
упоминалась в тексте.
2. Объясните, почему этот процесс называют гашением.
Ответ:__________________________________________________________________________
________________________________________________________________________________
1) CaO + H 2 O = Ca(OH) 2
2) При взаимодействии оксида кальция с водой выделяется большое
количество теплоты, поэтому вода закипает и шипит, как при попадании на раскалённый уголь, когда костёр гасят водой (или «гашением данный процесс назван, потому что в результате образуется гашёная известь»)
1. Составьте молекулярное уравнение реакции между гидроксидом кальция и углекислым
газом, которая упоминалась в тексте.
Ответ:__________________________________________________________________________
2. Объясните, какие особенности этой реакции позволяют использовать её для обнаружения
углекислого газа в воздухе.
Ответ:__________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
1) Ca(OH) 2 + CO 2 = CaCO 3 ↓ + H 2 O
2) В результате этой реакции образуется нерастворимое вещество – карбонат кальция, наблюдается помутнение исходного раствора, что и позволяет судить о наличии углекислого газа в воздухе (качественная
реакция на CO 2)
1. Составьте сокращённое ионное уравнение упомянутой в тексте реакции между
гидроксидом кальция и соляной кислотой.
Ответ:__________________________________________________________________________
2. Объясните, почему эту реакцию используют для повышения рН воды.
Ответ:__________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
1) OH – + H + = H 2 O (Ca(OH)2+ 2HCl = CaCl2 + 2H2O)
2) Наличие кислоты в природной воде обусловливает низкие значения pH этой воды. Гидроксид кальция нейтрализует кислоту, и значения pH повышаются
шкала pH существует от 0-14. от 0-6 — кислая среда, 7- нейтральная среда, 8-14 — щелочная среда
9. Дана схема окислительно-восстановительной реакции.
H 2 S + Fe 2 O 3 → FeS + S + H 2 O
1. Составьте электронный баланс этой реакции.
Ответ:__________________________________________________________________________
2. Укажите окислитель и восстановитель.
Ответ:__________________________________________________________________________
3. Расставьте коэффициенты в уравнении реакции.
Ответ:__________________________________________________________________________
1) Составлен электронный баланс:
| 2Fe +3 + 2ē → 2Fe +2 | 2 | 1 | |
| 2 | |||
| S -2 – 2ē → S 0 | 2 | 1 |
2) Указано, что сера в степени окисления –2 (или H 2 S) является восстановителем, а железо в степени окисления +3 (или Fe 2 O 3) – окислителем;
3) Составлено уравнение реакции:
3H 2 S + Fe 2 O 3 = 2FeS + S + 3H 2 O
10. Дана схема превращений:
Fe → FeCl 2 → Fe(NO 3) 2 → Fe(OH) 2
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить
указанные превращения.
1) _________________________________________________________________________
2) _________________________________________________________________________
3) _________________________________________________________________________
Написаны уравнения реакций, соответствующие схеме превращений:
1) Fe + 2HCl = FeCl 2 + H 2
2) FeCl 2 + 2AgNO 3 = Fe(NO 3) 2 + 2AgCl
3) Fe(NO 3) 2 + 2KOH = Fe(OH) 2 + 2KNO 3
(Допускаются иные, не противоречащие условию задания уравнения
реакций.)
11. Установите соответствие между формулой органического вещества и классом/группой , к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в таблицу выбранные цифры под соответствующими буквами.
Ответ:
| А | Б | В |
- C3H8 — CnH2n+2 — алкан
- C3H6 — CnH2n- алкен
- C2H6O — CnH2n+2O- спирт
12. В предложенные схемы химических реакций вставьте формулы пропущенных веществ и расставьте коэффициенты.
1) С 2 Н 6 + ……………..… → С 2 Н 5 Cl + HCl
2) C 3 H 6 + ……………..… → CO 2 + H 2 O
1) С 2 Н 6 + Cl 2 → С 2 Н 5 Cl + HCl
2) 2C 3 H 6 + 9O 2 → 6CO 2 + 6H 2 O
(Возможны дробные коэффициенты.)
13. Пропан сгорает с низким уровнем выброса токсичных веществ в атмосферу
, поэтому его используют в качестве источника энергии во многих областях, например в газовых зажигалках и при отоплении загородных домов.
Какой объём углекислого газа (н.у.) образуется при полном сгорании 4,4 г пропана?
Запишите подробное решение задачи.
Ответ:__________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
1) Составлено уравнение реакции горения пропана:
С 3 Н 8 + 5О 2 → 3СО 2 + 4Н 2 О
2) n(С 3 Н 8) = 4,4/44 = 0,1 моль
n(СО 2) = 3n(С 3 Н 8) = 0,3 моль
3) V(О 2) = 0,3 · 22,4 = 6,72 л
14. Изопропиловый спирт используют как универсальный растворитель: он входит в состав средств бытовой химии, парфюмерной и косметической продукции, стеклоомывающих жидкостей для автомобилей. В соответствии с приведённой ниже схемой составьте уравнения реакций получения этого спирта. При написании уравнений реакций используйте структурные формулы органических веществ.

1) _______________________________________________________
2) _______________________________________________________
3) _______________________________________________________
Написаны уравнения реакций, соответствующие схеме:

(Допускаются иные, не противоречащие условию задания уравнения реакций.)
15. Физиологическим раствором в медицине называют 0,9%-ный раствор хлорида натрия в воде.
Рассчитайте массу хлорида натрия и массу воды, которые необходимы для приготовления 500 г физиологического раствора. Запишите подробное решение задачи.
Ответ:__________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
1) m(NaCl) = 4,5 г
2) m(воды) = 495,5 г
m(р-ра) = 500г m(соли) = x
x/500 * 100%= 0,9%
m(cоли) = 500* (0,9/100)= 4,5 г
© 2017 Федеральная служба по надзору в сфере образования и науки Российской Федерации
Структура
Каждый вариант ВПР по химии содержит 15 заданий различных типов и уровней сложности.
В работе содержится 4 задания повышенного уровня сложности (их порядковые номера: 9, 10, 13, 14).
Включенные в работу задания условно могут быть распределены по четырем содержательным блокам: «Теоретические основы химии», «Неорганическая химия», «Органическая химия», «Методы познания в химии. Экспериментальные основы химии. Химия и жизнь».
Пояснения к оцениванию заданий
Верное выполнение задания с порядковым номером 3 оценивается в 1 балл.
Верное выполнение каждого из остальных заданий базового уровня сложности оценивается максимально 2 баллами. В случае наличия одной ошибки или неполного ответа выставляется 1 балл. Остальные варианты ответов считаются неверными и оцениваются в 0 баллов.
Оценивание заданий повышенного уровня сложности осуществляется на основе поэлементного анализа ответов учащихся. Максимальная оценка за верно выполненное задание составляет 3 балла. Задания с развернутым ответом могут быть выполнены учащимися разными способами. Поэтому приведенные в критериях оценивания образцы решений следует рассматривать лишь как один из возможных вариантов ответа.
В 2018 году ВПР по химии в 11 классах проводились по решению учебной организации, для выпускников, которые не выбрали этот предмет для сдачи ЕГЭ.
Для подготовки к ВПР 2019 пригодятся варианты 2018 года.
ВПР по химии 11 класс 2018 год варианты + ответы
Проверочная работа по химии условно разделена на четыре содержательных блока: «Теоретические основы химии», «Неорганическая химия», «Органическая химия», «Методы познания химии. Экспериментальные основы химии. Химия и жизнь».
Выпускники, принимающие участие в написании ВПР по химии, должны продемонстрировать базовый уровень знания предмета:
- составить уравнение химической реакции,
- смоделировать химический эксперимент на основании его описания,
- объяснить обусловленность свойств и способов получения веществ их составом и строением.
Проверочная работа для 11 класс включает в себя 15 заданий различных уровней сложности.
На выполнение всей работы отводится 1,5 часа (90 минут).
Задания, включённые в проверочную работу, проверяют овладение
выпускниками определёнными умениями и способами действий, которые
отвечают требованиям к уровню подготовки выпускников.
Таблица перевода баллов ВПР химии в оценку