Продуктом какого из процессов является этилен. Химические свойства этилена
этилен формула, этиленгликоль
Этиле́н
(по ИЮПАК: этен
) - органическое химическое соединение, описываемое формулой С2H4. Является простейшим алкеном (олефином), изологом этана. При нормальных условиях - бесцветный горючий газ со слабым запахом. Частично растворим в воде (25,6 мл в 100 мл воды при 0 °C), этаноле (359 мл в тех же условиях). Хорошо растворяется в диэтиловом эфире и углеводородах. Содержит двойную связь и поэтому относится к ненасыщенным или непредельным углеводородам. Играет чрезвычайно важную роль в промышленности, а также является фитогормоном. Этилен - самое производимое органическое соединение в мире; общее мировое производство этилена в 2008 году составило 113 миллионов тонн и продолжает расти на 2-3 % в год. Этилен обладает наркотическим действием. Класс опасности - четвёртый.
- 1 Получение
- 2 Структура производства
- 3 Применение
- 4 Электронное и пространственное строение молекулы
- 5 Основные химические свойства
- 6 Биологическая роль
- 7 Примечания
- 8 Литература
- 9 Ссылки
Получение
Этилен стали широко применять в качестве мономера перед Второй мировой войной в связи с необходимостью получения высококачественного изоляционного материала, способного заменить поливинилхлорид. После разработки метода полимеризации этилена под высоким давлением и изучения диэлектрических свойств получаемого полиэтилена началось его производство сначала в Великобритании, а позднее и в других странах.
Основным промышленным методом получения этилена является пиролиз жидких дистиллятов нефти или низших насыщенных углеводородов. Реакция проводится в трубчатых печах при 800-950°С и давлении 0,3 МПа. При использовании в качестве сырья прямогонного бензина выход этилена составляет примерно 30%. Одновременно с этиленом образуется также значительное количество жидких углеводородов, в том числе и ароматических. При пиролизе газойля выход этилена составляет примерно 15-25%. Наибольший выход этилена - до 50% - достигается при использовании в качестве сырья насыщенных углеводородов: этана, пропана и бутана. Их пиролиз проводят в присутствии водяного пара.
При выпуске с производства, при товарно-учетных операциях, при проверке его на соответствие нормативно-технической документации производится отбор проб этилена по процедуре, описанной в ГОСТ 24975.0-89 "Этилен и пропилен. Методы отбора проб". Отбор пробы этилена может производится и в газообразном и в сжиженном виде в специальные пробоотборники по ГОСТ 14921.
Промышленно получаемый в России этилен должен соответствовать требованиям, изложенным в ГОСТ 25070-2013 "Этилен. Технические условия".
Структура производства
В настоящее время в структуре производства этилена 64% приходится на крупнотоннажные установки пиролиза, ~ 17% - на малотоннажные установки газового пиролиза,~ 11% составляет пиролиз бензина и 8% падает на пиролиз этана.
Применение
Этилен является ведущим продуктом основного органического синтеза и применяется для получения следующих соединений (перечислены в алфавитном порядке):
- Винилацетат;
- Дихлорэтан / винилхлорид (3-е место, 12 % всего объёма);
- Окись этилена (2-е место, 14-15 % всего объёма);
- Полиэтилен (1-е место, до 60 % всего объёма);
- Стирол;
- Уксусная кислота;
- Этилбензол;
- Этиленгликоль;
- Этиловый спирт.
Этилен в смеси с кислородом использовался в медицине для наркоза вплоть до середины 80-х годов ХХ века в СССР и на ближнем Востоке. Этилен является фитогормоном практически у всех растений, среди прочего отвечает за опадание иголок у хвойных.
Электронное и пространственное строение молекулы
Атомы углерода находятся во втором валентном состоянии (sр2-гибридизация). результате, на плоскости под углом 120° образуются три гибридных облака, которые образуют три σ-связи с углеродом и двумя атомами водорода; p-электрон, который не участвовал в гибридизации, образует в перпендикулярной плоскости π-связь с р-электроном соседнего атома углерода. Так образуется двойная связь между атомами углерода. Молекула имеет плоскостное строение.
Основные химические свойства
Этилен - химически активное вещество. Так как в молекуле между атомами углерода имеется двойная связь, то одна из них, менее прочная, легко разрывается, и по месту разрыва связи происходит присоединение, окисление, полимеризация молекул.
- Галогенирование:
- Гидрирование:
- Гидрогалогенирование:
- Гидратация:
- Окисление:
- Горение:
- Полимеризация (получение полиэтилена):
- Димеризация (В.Ш.Фельдблюм. Димеризация и диспропорционирование олефинов. М.: Химия, 1978
Биологическая роль
Сигнальный каскад этилена у растений. Этилен легко проникает сквозь клеточную мембрану и связывается с рецепторами, расположенными на эндоплазматическом ретикулуме. Рецепторы после активации высвобождают связанный EIN2. Это активирует каскад передачи сигнала, который приводит к активации экспрессии определённых генов и в конечном итоге к включению специфического ответа на этилен у данного растения в данной фазе созревания. Активированные участки ДНК считываются в мРНК, которая, в свою очередь, в рибосомах считывается в функционирующий белок фермента, который катализирует биосинтез этилена, тем самым продукция этилена в ответ на изначальный этиленовый же сигнал повышается до определённого уровня, запуская каскад реакций созревания растения.Этилен у растений является своеобразным растительным гормоном, обладающим очень широким спектром биологических эффектов. Он действует в ничтожных, следовых количествах в течение всей жизни растения, стимулируя и регулируя процесс созревания плодов (в частности, фруктов), распускание бутонов (процесс цветения), опадание листьев, рост корневой системы растений.
В коммерческом сборе плодов и фруктов используют специальные комнаты или камеры для дозревания плодов, в атмосферу которых этилен впрыскивается из специальных каталитических генераторов, производящих газообразный этилен из жидкого этанола. Обычно для стимулирования дозревания плодов используется концентрация газообразного этилена в атмосфере камеры от 500 до 2000 ppm в течение 24-48 часов. При более высокой температуре воздуха и более высокой концентрации этилена в воздухе дозревание плодов идёт быстрее. Важно, однако, при этом обеспечивать контроль содержания углекислого газа в атмосфере камеры, поскольку высокотемпературное созревание (при температуре выше 20 градусов Цельсия) или созревание при высокой концентрации этилена в воздухе камеры приводит к резкому повышению выделения углекислого газа быстро созревающими плодами, порой до 10 % углекислоты в воздухе спустя 24 часа от начала дозревания, что может привести к углекислотному отравлению как работников, убирающих уже дозревшие плоды, так и самих фруктов.
Этилен использовался для стимулирования созревания плодов ещё в Древнем Египте. Древние египтяне намеренно царапали или слегка мяли, отбивали финики, фиги и другие плоды с целью стимулировать их созревание (повреждение тканей стимулирует образование этилена тканями растений). Древние китайцы сжигали деревянные ароматические палочки или ароматические свечи в закрытых помещениях с целью стимулировать созревание персиков (при сгорании свеч или дерева выделяется не только углекислый газ, но и недоокисленные промежуточные продукты горения, в том числе и этилен). 1864 году было обнаружено, что утечка природного газа из уличных фонарей вызывает торможение роста близлежащих растений в длину, их скручивание, аномальное утолщение стеблей и корней и ускоренное созревание плодов. 1901 году русский учёный Дмитрий Нелюбов показал, что активным компонентом природного газа, вызывающим эти изменения, является не основной его компонент, метан, а присутствующий в нём в малых количествах этилен. Позднее в 1917 году Сара Дубт доказала, что этилен стимулирует преждевременное опадание листьев. Однако только в 1934 году Гейн обнаружил, что сами растения синтезируют эндогенный этилен. 1935 году Крокер предположил, что этилен является растительным гормоном, ответственным за физиологическое регулирование созревания плодов, а также за старение вегетативных тканей растения, опадание листьев и торможение роста.
Цикл Янга
Цикл биосинтеза этилена начинается с превращения аминокислоты метионина в S-аденозил-метионин (SAMe) при помощи фермента метионин-аденозилтрансферазы. Затем S-аденозил-метионин превращается в 1-аминоциклопропан-1-карбоксиловую кислоту (АЦК, ACC) при помощи фермента 1-аминоциклопропан-1-карбоксилат-синтетазы (АЦК-синтетазы). Активность АЦК-синтетазы лимитирует скорость всего цикла, поэтому регуляция активности этого фермента является ключевой в регуляции биосинтеза этилена у растений. Последняя стадия биосинтеза этилена требует наличия кислорода и происходит при действии фермента аминоциклопропанкарбоксилат-оксидазы (АЦК-оксидазы), ранее известной как этиленобразующий фермент. Биосинтез этилена у растений индуцируется как экзогенным, так и эндогенным этиленом (положительная обратная связь). Активность АЦК-синтетазы и, соответственно, образование этилена повышается также при высоких уровнях ауксинов, в особенности индолуксусной кислоты, и цитокининов.
Этиленовый сигнал у растений воспринимается минимум пятью различными семействами трансмембранных рецепторов, представляющих собой димеры белков. Известен, в частности, рецептор этилена ETR1 у арабидопсиса (Arabidopsis). Гены, кодирующие рецепторы для этилена, были клонированы у арабидопсиса и затем у томата. Этиленовые рецепторы кодируются множеством генов как в геноме арабидопсиса, так и в геноме томатов. Мутации в любом из семейства генов, которое состоит из пяти типов этиленовых рецепторов у арабидопсиса и минимум из шести типов рецепторов у томата, могут привести к нечувствительности растений к этилену и нарушениям процессов созревания, роста и увядания. Последовательности ДНК, характерные для генов этиленовых рецепторов, были обнаружены также у многих других видов растений. Более того, этиленсвязывающий белок был найден даже у цианобактерий.
Неблагоприятные внешние факторы, такие, как недостаточное содержание кислорода в атмосфере, наводнение, засуха, заморозки, механическое повреждение (ранение) растения, нападение патогенных микроорганизмов, грибков или насекомых, могут вызывать повышенное образование этилена в тканях растений. Так, например, при наводнении корни растения страдают от избытка воды и недостатка кислорода (гипоксии), что приводит к биосинтезу в них 1-аминоциклопропан-1-карбоксиловой кислоты. АЦК затем транспортируется по проводящим путям в стеблях вверх, до листьев, и в листьях окисляется до этилена. Образовавшийся этилен способствует эпинастическим движениям, приводящим к механическому стряхиванию воды с листьев, а также увяданию и опаданию листьев, лепестков цветков и плодов, что позволяет растению одновременно и избавиться от избытка воды в организме, и сократить потребность в кислороде за счёт сокращения общей массы тканей.
Небольшие количества эндогенного этилена также образуются в клетках животных, включая человека, в процессе перекисного окисления липидов. Некоторое количество эндогенного этилена затем окисляется до этиленоксида, который обладает способностью алкилировать ДНК и белки, в том числе гемоглобин (формируя специфический аддукт с N-терминальным валином гемоглобина - N-гидроксиэтил-валин). Эндогенный этиленоксид также может алкилировать гуаниновые основания ДНК, что приводит к образованию аддукта 7-(2-гидроксиэтил)-гуанина, и является одной из причин присущего всем живым существам риска эндогенного канцерогенеза. Эндогенный этиленоксид также является мутагеном. С другой стороны, существует гипотеза, что если бы не образование в организме небольших количеств эндогенного этилена и соответственно этиленоксида, то скорость возникновения спонтанных мутаций и соответственно скорость эволюции была бы значительно ниже.
Примечания
- Devanney Michael T. Ethylene (англ.). SRI Consulting (September 2009). Архивировано из первоисточника 21 августа 2011.
- Ethylene (англ.). WP Report. SRI Consulting (January 2010). Архивировано из первоисточника 21 августа 2011.
- Газохроматографическое измерение массовых концентраций углеводородов: метана, этана, этилена, пропана, пропилена, нбутана, альфа-бутилена, изопентана в воздухе рабочей зоны. Методические указания. МУК 4.1.1306-03 (УТВ. ГЛАВНЫМ ГОСУДАРСТВЕННЫМ САНИТАРНЫМ ВРАЧОМ РФ 30.03.2003)
- «РОСТ И РА3ВИТИЕ РАСТЕНИЙ» В. В. Чуб
- «Delaying Christmas tree needle loss»
- Хомченко Г.П. §16.6. Этилен и его гомологи // Химия для поступающих в вузы. - 2-е изд. - М.: Высшая школа, 1993. - С. 345. - 447 с. - ISBN 5-06-002965-4.
- 1 2 3 Lin, Z.; Zhong, S.; Grierson, D. (2009). «Recent advances in ethylene research». J. Exp. Bot. 60 (12): 3311–36. DOI:10.1093/jxb/erp204. PMID 19567479.
- Ethylene and Fruit Ripening / J Plant Growth Regul (2007) 26:143–159 doi:10.1007/s00344-007-9002-y (англ.)
- External Link to More on Ethylene Gassing and Carbon Dioxide Control. ne-postharvest.com (недоступная ссылка с 06-06-2015 (13 дней))
- Neljubov D. (1901). «Uber die horizontale Nutation der Stengel von Pisum sativum und einiger anderen Pflanzen». Beih Bot Zentralbl 10 : 128–139.
- Doubt, Sarah L. (1917). «The Response of Plants to Illuminating Gas». Botanical Gazette 63 (3): 209–224. DOI:10.1086/332006.
- Gane R. (1934). «Production of ethylene by some fruits». Nature 134 (3400): 1008. DOI:10.1038/1341008a0. Bibcode: 1934Natur.134.1008G.
- Crocker W, Hitchcock AE, Zimmerman PW. (1935) «Similarities in the effects of ethlyene and the plant auxins». Contrib. Boyce Thompson Inst. 7. 231-48. Auxins Cytokinins IAA Growth substances, Ethylene
- Yang, S. F., and Hoffman N. E. (1984). «Ethylene biosynthesis and its regulation in higher plants». Ann. Rev. Plant Physiol. 35 : 155–89. DOI:10.1146/annurev.pp.35.060184.001103.
- Bleecker A. B., Esch J. J., Hall A. E., Rodríguez F. I., Binder B. M. The ethylene-receptor family from Arabidopsis: structure and function. (англ.) // Philosophical transactions of the Royal Society of London. Series B, Biological sciences. - 1998. - Vol. 353. - № 1374. - P. 1405–1412. - DOI:10.1098/rstb.1998.0295 - PMID 9800203. исправить
- Explaining Epinasty. planthormones.inf
- (1992) «Pharmacokinetics of ethylene in man; body burden with ethylene oxide and hydroxyethylation of hemoglobin due to endogenous and environmental ethylene.». Arch Toxicol. 66 (3): 157-163. PMID 1303633.
- (1997) «A note on the physiological background of the ethylene oxide adduct 7-(2-hydroxyethyl)guanine in DNA from human blood.». Arch Toxicol. 71 (11): 719-721. PMID 9363847.
- (May 15, 2000) «A physiological toxicokinetic model for exogenous and endogenous ethylene and ethylene oxide in rat, mouse, and human: formation of 2-hydroxyethyl adducts with hemoglobin and DNA.». Toxicol Appl Pharmacol. 165 (1): 1-26. PMID 10814549.
- (Sep 2000) «Carcinogenicity and genotoxicity of ethylene oxide: new aspects and recent advances.». Crit Rev Toxicol. 30 (5): 595-608. PMID 11055837.
Литература
- Горбов А. И.,. Этилен // Энциклопедический словарь Брокгауза и Ефрона: в 86 т. (82 т. и 4 доп.). - СПб., 1890-1907.
- ГОСТ 24975.0-89 Этилен и пропилен. Методы отбора проб
- ГОСТ 25070-87 Этилен. Технические условия
Ссылки
- Безуглова О. С. Этилен. Удобрения и стимуляторы роста. Проверено 22 февраля 2015.
| Углеводороды | |
|---|---|
| Алканы | Метан Этан Пропан Бутан Пентан Гексан Гептан Октан Нонан Декан Ундекан Додекан Тридекан Тетрадекан Гексадекан Октадекан Нонадекан Эйкозан Докозан Гектан |
| Алкены | Пропен Бутены Пентены Гексены Гептены Октен |
| Алкины | Ацетилен Пропин Бутин |
| Диены | Пропадиен Бутадиен Изопрен Циклобутадиен |
| Другие ненасыщеные | Винилацетилен Диацетилен Каротин |
| Циклоалканы | Циклопропан Циклобутан Циклопентан Циклогексан Декалин Индан Инден |
| Ароматические | Бензол Толуол Диметилбензолы Этилбензол Пропилбензол Кумол Стирол Фенилацетилен Индан Дифенил Дифенилметан Трифенилметан Тетрафенилметан Инден |
| Полициклические | Нафталин Антрацен Бензантрацен Пентацен Фенантрен Пирен Бензпирен Азулен Хризен |
| Нефтегазовый комплекс | |
|---|---|
| Геофизическая разведка | Нефтепромысловое дело (Моделирование пласта-коллектора) | Геология нефти | Сейсмология | Петрофизика |
| Методы добычи нефти и газа | Бурение | Вскрытие нефтяного пласта | Каротаж | Пробоотборник | Механизированная (насосно-компрессорная) добыча (Погружной насос | Газлифт) | Подземный ремонт скважины | Плазменно-импульсное воздействие | Третичный метод нефтедобычи (Нагнетание пара в пласт | Закачка химических реагентов) |
| Типы буровых установок | Буровая вышка | Станок-качалка | Нефтяная платформа (Стационарная нефтяная платформа | Морская нефтяная платформа, свободно закреплённая ко дну | Полупогружная нефтяная буровая платформа | Мобильная морская платформа с выдвижными опорами | Буровое судно | Нефтяная платформа с растянутыми опорами | Плавучая установка для добычи, хранения и отгрузки нефти) |
| Транспортировка и переработка | Нефтехранилище | Трубопровод (Нефтепровод | Газопровод) | Нефтеперерабатывающий завод | (Основные стадии технологии переработки нефти | Многократное испарение | Нефтехимический синтез | Сухая перегонка | Нефтехимия | Висбрекинг | Гидрокрекинг | Каталитический крекинг | Каталитический риформинг | Крекинг | Процесс Клауса | Термолиз) | Коксование |
| Юридический аспект | Соглашение о разделе продукции | Система налогообложения при выполнении соглашений о разделе продукции | концессионное соглашение | Сервисное соглашение | Лицензия на добычу нефти и газа | Роялти |
| Крупные ТНК и международные организации |
ExxonMobil | Royal Dutch Shell | |Chevron Corporation | ConocoPhillips | Total S.A. | ОАПЕК | ОПЕК | (Корзина ОПЕК) |
| Сорта товарной нефти (Классификация нефтей) |
Brent | Dubai Crude | ESPO | Sokol | Tengiz | Urals | West Texas Intermediate |
| Типы сырья | Нефть | Газовый конденсат | Нефтяные газы | Природный газ | Сжиженный нефтяной газ | Битуминозные пески | Мальта | Нефтяные воды | Озокерит | Природный битум | Природный асфальт |
| Нефтепродукты и газпродукты | JP-8 | HCNG | Авиакеросин | Асфальт | Асфальтены | Бензин | Галоша | Бензол | Битумы нефтяные | Вазелин | Газойль | Газолин | Гексадекан | Генераторный газ | Горюче-смазочные материалы | Гудрон | Дизельное топливо | Диметилбензолы | Керосин | Креолин | Лигроин | Мазут | Метан | Метан угольных пластов | Метил-трет-бутиловый эфир | Моторные масла | Нефтяной кокс | Нефтяные масла | Парафин | Петролейный эфир | Полипропилен | Присадка | Пропан | Пропилен | Свалочный газ | Синтез-газ | Технический углерод | Толуол | Уайт-спирит | Церезин | |
| История | Эмбарго нефти 1967 года | Нефтяной кризис 1973 года | Энергетический кризис 1979 года | Перепроизводство нефти в 1980-х годах | Энергетический кризис 2000х | Основатели нефтегазовой индустрии | История нефтегазовой индустрии | Национализация нефтедобычи | Семь сестёр | Standard Oil |
| Некоторые числовые параметры | Объёмный коэффициент нефти | Коэффициент теплового расширения | Глубина переработки нефти |
| См. также | Пик нефти | Банк качества нефти | Баррель (американский нефтяной) | Дебит скважин | Нефтеотдача (КИН) | Энергетический кризис |
этилен, этилен алу, этилен горит реакция, этилен из хлорэтана, этилен формула, этилен химия формула, этилен это, этиленвинилацетат, этиленгликоль, этиленовые углеводороды
Этилен Информацию О
С другом двойной связью.
1. Физические свойства
Этилен - бесцветный газ со слабым приятным запахом. Он немного легче воздуха. В воде мало растворим, а в спирте и других органических растворителях растворяется хорошо.
2. Строение
Молекулярная формула С 2 Н 4. Структурная и электронная формулы:
3. Химические свойства
В отличие от метана этилен химически довольно активен. Для него характерны реакции присоединения по месту двойной связи, реакции полимеризации и реакции окисления. При этом один из двойных связей разрывается и на его месте остается простой одинарный связь, а за счет уволенных валентностей происходит присоединение других атомов или атомных групп. Рассмотрим это на примерах некоторых реакций. При пропускании этилена в бромную воду (водный раствор брома) последняя обесцвечивается результате взаимодействия этилена с бромом с образованием дибромэтан (бромистого этилена) C 2 H 4 Br 2:

Как видно из схемы этой реакции, здесь происходит не замещение атомов водорода атомами галогена, как в насыщенных углеводородов, а присоединение атомов брома по месту двойной связи. Этилен легко обесцвечивает также фиолетовый цвет водного раствора манганатом калия KMnO 4 даже при обычной температуре. Сам же этилен при этом окисляется в этиленгликоль C 2 H 4 (OH) 2. Этот процесс можно изобразить следующим уравнением:
- 2KMnO 4 -> K 2 MnO 4 + MnO 2 + 2O

Реакции взаимодействия этилена с бромом и манганатом калия служат для открытия ненасыщенных углеводородов. Метан и другие насыщенные углеводороды, как уже отмечалось, с манганатом калия не взаимодействуют.
Этилен вступает в реакцию с водородом. Так, когда смесь этилена с водородом нагреть в присутствии катализатора (порошка никеля, платины или палладия), то они сочетаются с образованием этана :

Реакции, при которых происходит присоединение водорода к веществу, называются реакциями гидрирования или гидрогенизации. Реакции гидрогенизации имеют большое практическое значение. их довольно часто используется в промышленности. В отличие от метана этилен горит на воздухе свитящим пламенем, поскольку содержит больше углерода, чем метан. Поэтому не весь углерод сгорает сразу и частицы его сильно раскаляются и светятся. Затем эти частицы углерода сгорают в наружной части пламени:
- C 2 H 4 + 3O 2 = 2CO 2 + 2H 2 O
С воздухом этилен, как метан, образует взрывчатые смеси.
4. Получение
В природе этилен не встречается, за исключением незначительных примесей в природном газе. В лабораторных условиях этилен обычно получают при действии концентрированной серной кислоты на этиловый спирт при нагревании. Этот процесс можно изобразить следующим суммарным уравнением:

Во время реакции от молекулы спирта вычитаются элементы воды, а уволено две валентности насыщают друг друга с образованием двойной связи между атомами углерода. Для промышленных целей этилен получают в больших количествах из газов крекинга нефти.
5. Применение
В современной промышленности этилен применяется достаточно широко для синтеза этилового спирта и производства важных полимерных материалов (полиэтилен и др.)., А также для синтеза других органических веществ. Очень интересна свойство этилена ускорять созревание многих огородных и садовых плодов (помидоров, дынь, груш, лимонов и т.п.). Используя это, плоды можно транспортировать еще зелеными, а затем доводить их до спелого состояния уже на месте потребления, вводя в воздух складских помещений небольшие количества этилена.
Из этилена производят хлористый винил и поливинилхлорид, бутадиен и синтетические каучуки, оксид этилена и полимеры на его основе, этиленгликоль и т.д..
Примечания
Источники
- Ф. А. Деркач "Химия" Л. 1968
|
||||||||
| ||||||||
Этилен является простейшим из органических соединений, известных как алкены. Это бесцветный имеющий сладковатый вкус и запах. Природные источники включают природный газ и нефть, он также является естественным гормоном в растениях, в которых он ингибирует рост и способствует созреванию плодов. Применение этилена является распространенным явлением в промышленной органической химии. Он производится путем нагревания природного газа, температура плавления составляет 169,4 °С, кипения - 103, 9 °С.
Этилен: особенности структуры и свойства
Углеводороды представляют собой молекулы, содержащие водород и углерод. Они сильно различаются с точки зрения количества одинарных и двойных связей и структурной ориентации каждого компонента. Одним из простейших, но биологически и экономически выгодных углеводородов является этилен. Он поставляется в газообразном виде, является бесцветным и легковоспламеняющимся. Он состоит из двух двойных скрепленных атомов углерода с атомами водорода. Химическая формула имеет вид C 2 H 4 . Структурная форма молекулы является линейной из-за наличия двойной связи в центре.
Этилен имеет сладковатый мускусный запах, который позволяет легко идентифицировать вещество в воздухе. Это касается газа в чистом виде: запах может исчезать при смешивании с другими химическими веществами.

Схема применения этилена
Этилен используют в двух основных категориях: в качестве мономера, из которого построены большие углеродные цепи, и в качестве исходного материала для других двух-углеродных соединений. Полимеризации - это повторяющиеся объединения множества мелких молекул этилена в более крупные. Этот процесс происходит при высоких давлениях и температурах. Области применения этилена многочисленны. Полиэтилен - это полимер, который используется особенно массово в производстве упаковочных пленок, проволочных покрытий и пластиковых бутылок. Еще одно применение этилена в качестве мономера касается формирования линейных α-олефинов. Этилен является исходным материалом для приготовления ряда двух-углеродных соединений, таких как этанол (технический спирт), (антифриз, и пленки), ацетальдегида и винил хлорида. Кроме этих соединений, этилен с бензолом образует этилбензол, который используется в производстве пластмасс и Рассматриваемое вещество является одним из простейших углеводородов. Однако свойства этилена делают его биологически и хозяйственно значимым.

Коммерческое использование
Свойства этилена дают хорошую коммерческую основу для большого количества органических (содержащих углерод и водород) материалов. Одиночные молекулы этилена могут быть соединены вместе для получения полиэтилена (что означает много молекул этилена). Полиэтилен используется для изготовления пластмасс. Кроме того, он может быть использован для изготовления моющих средств и синтетических смазочных материалов, которые представляют собой химические вещества, используемые для уменьшения трения. Применение этилена для получения стиролов актуально в процессе создания резины и защитной упаковки. Кроме того, он используется в обувной промышленности, особенно это касается спортивной обуви, а также при производстве автомобильных покрышек. Применение этилена является коммерчески важным, а сам газ является одним из наиболее часто производимых углеводородов в глобальном масштабе.
Опасность для здоровья
Этилен представляет опасность для здоровья прежде всего потому, что он является легковоспламеняющимся и взрывоопасным. Он также может действовать как наркотик при низких концентрациях, вызывая тошноту, головокружение, головные боли и потерю координации движения. При более высоких концентрациях он действует как анестетик, вызывая потерю сознания, и другим раздражителям. Все эти негативные моменты могут быть причиной для беспокойства в первую очередь для людей, непосредственно работающих с газом. Количество этилена, с которым большинство людей сталкивается в повседневной жизни, как правило, сравнительно небольшое.

Реакции этилена
1) Окисление. Это добавление кислорода, например, при окислении этилена до окиси этилена. Он используется в производстве этиленгликоля (1,2-этандиола), который применяется в качестве незамерзающей жидкости и в производстве полиэфиров путем конденсационной полимеризации.
2) Галогенирование - реакции с этиленом фтора, хлора, брома, йода.
3) Хлорирование этилена в виде 1,2-дихлорэтана и последующая конверсия 1,2-дихлорэтана в винилхлорид мономер. 1,2-дихлорэтан является полезным органическим растворителем, а также является ценным предшественником в синтезе винилхлорида.

4) Алкилирование - добавление углеводородов по двойной связи, например, синтез этилбензола из этилена и бензола с последующим преобразованием в стирол. Этилбензол является промежуточным для производства стирола, одного из наиболее широко используемых виниловых мономеров. Стирол - мономер, используемый для производства полистирола.
5) Горение этилена. Газ получается путем нагревания и концентрированной серной кислоты.
6) Гидратация - реакция с добавлением воды к двойной связи. Наиболее важным промышленным применением этой реакции является превращение этилена в этанол.
Этилен и горение
Этилен - это газ без цвета, который плохо растворяется в воде. Горение этилена в воздухе сопровождается образованием углекислого газа и воды. В чистом виде газ горит световым диффузионным пламенем. Смешанный с небольшим количеством воздуха, он дает пламя, состоящее из трех отдельных слоев - внутреннего сердечника - несгоревшего газа, сине-зеленого слоя и внешнего конуса, где частично окисленный продукт из предварительно перемешанного слоя сгорают в диффузионном пламени. Результирующее пламя показывает сложную серию реакций, а если к газовой смеси добавляется больше воздуха, постепенно диффузионный слой исчезает.

Полезные факты
1) Этилен является природным растительным гормоном, он влияет на рост, развитие, созревание и старение всех растений.
2) Газ не вреден и не токсичен для человека в определенной концентрации (100-150 мг).
3) Он используется в медицине в качестве обезболивающего средства.
4) Действие этилена замедляется при низких температурах.
5) Характерным свойством является хорошая проникающая способность через большинство веществ, например через картонные упаковочные коробки, деревянные и даже бетонные стены.
6) В то время как он имеет неоценимое значение благодаря своей способности инициировать процесс созревания, он также может быть очень вредным для многих фруктов, овощей, цветов и растений, ускоряя процесс старения и снижая качество продукта и его срок годности. Степень повреждения зависит от концентрации, продолжительности воздействия и температуры.
7) Этилен взрывоопасен при высоких концентрациях.
8) Этилен используется в производстве стекла специального назначения для автомобильной промышленности.
9) Изготовление металлоконструкций: газ используется в качестве кислородно-топливного газа для резки металла, сварки и высокой скорости термического напыления.
10) Нефтепереработка: этилен используется в качестве хладагента, особенно на производстве по сжижению природного газа.
11) Как уже говорилось ранее, этилен является очень реактивным веществом, кроме того, он еще и очень легко воспламеняется. Из соображений безопасности, его обычно транспортируют по специальному отдельному газопроводу.
12) Одним из самых распространенных продуктов, изготовленных непосредственно из этилена, является пластмасса.
Энциклопедичный YouTube
-
1 / 5
Этилен стали широко применять в качестве мономера перед Второй мировой войной в связи с необходимостью получения высококачественного изоляционного материала, способного заменить поливинилхлорид. После разработки метода полимеризации этилена под высоким давлением и изучения диэлектрических свойств получаемого полиэтилена началось его производство сначала в Великобритании, а позднее и в других странах.
Основным промышленным методом получения этилена является пиролиз жидких дистиллятов нефти или низших насыщенных углеводородов. Реакция проводится в трубчатых печах при +800-950 °С и давлении 0,3 МПа. При использовании в качестве сырья прямогонного бензина выход этилена составляет примерно 30 %. Одновременно с этиленом образуется также значительное количество жидких углеводородов, в том числе и ароматических. При пиролизе газойля выход этилена составляет примерно 15-25 %. Наибольший выход этилена - до 50 % - достигается при использовании в качестве сырья насыщенных углеводородов: этана, пропана и бутана. Их пиролиз проводят в присутствии водяного пара.
При выпуске с производства, при товарно-учётных операциях, при проверке его на соответствие нормативно-технической документации производится отбор проб этилена по процедуре, описанной в ГОСТ 24975.0-89 «Этилен и пропилен . Методы отбора проб». Отбор пробы этилена может производится и в газообразном и в сжиженном виде в специальные пробоотборники по ГОСТ 14921.
Промышленно получаемый в России этилен должен соответствовать требованиям, изложенным в ГОСТ 25070-2013 «Этилен. Технические условия».
Структура производства
В настоящее время в структуре производства этилена 64 % приходится на крупнотоннажные установки пиролиза, ~17 % - на малотоннажные установки газового пиролиза, ~11 % составляет пиролиз бензина и 8 % падает на пиролиз этана .
Применение
Этилен является ведущим продуктом основного органического синтеза и применяется для получения следующих соединений (перечислены в алфавитном порядке):
- Дихлорэтан / винилхлорид (3-е место, 12 % всего объёма);
- Окись этилена (2-е место, 14-15 % всего объёма);
- Полиэтилен (1-е место, до 60 % всего объёма);
Этилен в смеси с кислородом использовался в медицине для наркоза вплоть до середины 1980-х годов в СССР и на ближнем Востоке. Этилен является фитогормоном практически у всех растений , среди прочего отвечает за опадание иголок у хвойных.
Электронное и пространственное строение молекулы
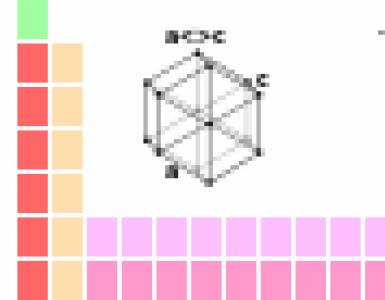
Атомы углерода находятся во втором валентном состоянии (sр 2 -гибридизация). В результате, на плоскости под углом 120° образуются три гибридных облака, которые образуют три σ-связи с углеродом и двумя атомами водорода; p-электрон, который не участвовал в гибридизации, образует в перпендикулярной плоскости π-связь с р-электроном соседнего атома углерода. Так образуется двойная связь между атомами углерода. Молекула имеет плоскостное строение.
CH 2 =CH 2
Основные химические свойства
Этилен - химически активное вещество. Так как в молекуле между атомами углерода имеется двойная связь, то одна из них, менее прочная, легко разрывается, и по месту разрыва связи происходит присоединение, окисление, полимеризация молекул.
- Галогенирование:
- Гидрирование:
- Гидрогалогенирование:
- Гидратация:
- Окисление:
- Горение:
- Полимеризация (получение полиэтилена):
- Димеризация (В. Ш. Фельдблюм. Димеризация и диспропорционирование олефинов. М.: Химия, 1978)
Биологическая роль
Этилен - первый из обнаруженных газообразных растительных гормонов , обладающий очень широким спектром биологических эффектов. Этилен выполняет в жизненном цикле растений многообразные функции, среди которых контроль развития проростка, созревание плодов (в частности, фруктов) , распускание бутонов (процесс цветения), старение и опадание листьев и цветков. Этилен называют также гормоном стресса, так как он участвует в реакции растений на биотический и абиотический стресс, и синтез его в органах растений усиливается в ответ на разного рода повреждения. Кроме того, являясь летучим газообразным веществом, этилен осуществляет быструю коммуникацию между разными органами растений и между растениями в популяции, что важно. в частности, при развитии стресс-устойчивости.
К числу наиболее известных функций этилена относится развитие так называемого тройного ответа у этиолированных (выращенных в темноте) проростков при обработке этим гормоном. Тройной ответ включает в себя три реакции: укорочение и утолщение гипокотиля, укорочение корня и усиление апикального крючка (резкий изгиб верхней части гипокотиля). Ответ проростков на этилен крайне важен на первых этапах их развития, так как способствует пробивание ростков к свету.
В коммерческом сборе плодов и фруктов используют специальные комнаты или камеры для дозревания плодов , в атмосферу которых этилен впрыскивается из специальных каталитических генераторов, производящих газообразный этилен из жидкого этанола . Обычно для стимулирования дозревания плодов используется концентрация газообразного этилена в атмосфере камеры от 500 до 2000 ppm в течение 24-48 часов. При более высокой температуре воздуха и более высокой концентрации этилена в воздухе дозревание плодов идёт быстрее. Важно, однако, при этом обеспечивать контроль содержания углекислого газа в атмосфере камеры, поскольку высокотемпературное созревание (при температуре выше 20 градусов Цельсия) или созревание при высокой концентрации этилена в воздухе камеры приводит к резкому повышению выделения углекислого газа быстро созревающими плодами, порой до 10 % углекислоты в воздухе спустя 24 часа от начала дозревания, что может привести к углекислотному отравлению как работников, убирающих уже дозревшие плоды, так и самих фруктов.
Этилен использовался для стимулирования созревания плодов ещё в Древнем Египте. Древние египтяне намеренно царапали или слегка мяли, отбивали финики, фиги и другие плоды с целью стимулировать их созревание (повреждение тканей стимулирует образование этилена тканями растений). Древние китайцы сжигали деревянные ароматические палочки или ароматические свечи в закрытых помещениях с целью стимулировать созревание персиков (при сгорании свеч или дерева выделяется не только углекислый газ, но и недоокисленные промежуточные продукты горения, в том числе и этилен). В 1864 году было обнаружено, что утечка природного газа из уличных фонарей вызывает торможение роста близлежащих растений в длину, их скручивание, аномальное утолщение стеблей и корней и ускоренное созревание плодов. В 1901 году русский учёный Дмитрий Нелюбов показал, что активным компонентом природного газа, вызывающим эти изменения, является не основной его компонент, метан, а присутствующий в нём в малых количествах этилен. Позднее в 1917 году Сара Дубт доказала, что этилен стимулирует преждевременное опадание листьев. Однако только в 1934 году Гейн обнаружил, что сами растения синтезируют эндогенный этилен. В 1935 году Крокер предположил, что этилен является растительным гормоном, ответственным за физиологическое регулирование созревания плодов, а также за старение вегетативных тканей растения, опадание листьев и торможение роста.
Цикл биосинтеза этилена начинается с превращения аминокислоты метионина в S-аденозил-метионин (SAMe) при помощи фермента метионин-аденозилтрансферазы. Затем S-аденозил-метионин превращается в 1-аминоциклопропан-1-карбоксиловую кислоту (АЦК, ACC ) при помощи фермента 1-аминоциклопропан-1-карбоксилат-синтетазы (АЦК-синтетазы). Активность АЦК-синтетазы лимитирует скорость всего цикла, поэтому регуляция активности этого фермента является ключевой в регуляции биосинтеза этилена у растений. Последняя стадия биосинтеза этилена требует наличия кислорода и происходит при действии фермента аминоциклопропанкарбоксилат-оксидазы (АЦК-оксидазы), ранее известной как этиленобразующий фермент. Биосинтез этилена у растений индуцируется как экзогенным, так и эндогенным этиленом (положительная обратная связь). Активность АЦК-синтетазы и, соответственно, образование этилена повышается также при высоких уровнях ауксинов , в особенности индолуксусной кислоты, и цитокининов .
Этиленовый сигнал у растений воспринимается минимум пятью различными семействами трансмембранных рецепторов, представляющих собой димеры белков. Известен, в частности, рецептор этилена ETR 1 у арабидопсиса (Arabidopsis ). Гены, кодирующие рецепторы для этилена, были клонированы у арабидопсиса и затем у томата . Этиленовые рецепторы кодируются множеством генов как в геноме арабидопсиса, так и в геноме томатов. Мутации в любом из семейства генов, которое состоит из пяти типов этиленовых рецепторов у арабидопсиса и минимум из шести типов рецепторов у томата, могут привести к нечувствительности растений к этилену и нарушениям процессов созревания, роста и увядания. Последовательности ДНК, характерные для генов этиленовых рецепторов, были обнаружены также у многих других видов растений. Более того, этиленсвязывающий белок был найден даже у цианобактерий.
Неблагоприятные внешние факторы, такие, как недостаточное содержание кислорода в атмосфере, наводнение, засуха, заморозки, механическое повреждение (ранение) растения, нападение патогенных микроорганизмов, грибков или насекомых, могут вызывать повышенное образование этилена в тканях растений. Так, например, при наводнении корни растения страдают от избытка воды и недостатка кислорода (гипоксии), что приводит к биосинтезу в них 1-аминоциклопропан-1-карбоксиловой кислоты. АЦК затем транспортируется по проводящим путям в стеблях вверх, до листьев, и в листьях окисляется до этилена. Образовавшийся этилен способствует эпинастическим движениям, приводящим к механическому стряхиванию воды с листьев, а также увяданию и опаданию листьев, лепестков цветков и плодов, что позволяет растению одновременно и избавиться от избытка воды в организме, и сократить потребность в кислороде за счёт сокращения общей массы тканей.
Небольшие количества эндогенного этилена также образуются в клетках животных, включая человека, в процессе перекисного окисления липидов. Некоторое количество эндогенного этилена затем окисляется до этиленоксида , который обладает способностью алкилировать ДНК и белки , в том числе гемоглобин (формируя специфический аддукт с N-терминальным валином гемоглобина - N-гидроксиэтил-валин). Эндогенный этиленоксид также может алкилировать гуаниновые основания ДНК, что приводит к образованию аддукта 7-(2-гидроксиэтил)-гуанина, и является одной из причин присущего всем живым существам риска эндогенного канцерогенеза. Эндогенный этиленоксид также является мутагеном. С другой стороны, существует гипотеза, что если бы не образование в организме небольших количеств эндогенного этилена и соответственно этиленоксида, то скорость возникновения спонтанных мутаций и соответственно скорость эволюции была бы значительно ниже.
Примечания
- Devanney Michael T. Ethylene (англ.) . SRI Consulting (September 2009). Архивировано 21 августа 2011 года.
- Ethylene (англ.) . WP Report . SRI Consulting (January 2010). Архивировано 21 августа 2011 года.
- Газохроматографическое измерение массовых концентраций углеводородов: метана, этана, этилена, пропана, пропилена, бутана, альфа-бутилена, изопентана в воздухе рабочей зоны. Методические указания. МУК 4.1.1306-03 (Утв. главным государственным санитарным врачом РФ 30.03.2003)
- «Рост и развитие растений» В. В. Чуб
- «Delaying Christmas tree needle loss»
- Хомченко Г.П. §16.6. Этилен и его гомологи // Химия для поступающих в вузы. - 2-е изд. - М. : Высшая школа , 1993. - С. 345. - 447 с. - ISBN 5-06-002965-4 .
- Lin, Z.; Zhong, S.; Grierson, D. (2009). «Recent advances in ethylene research». J. Exp. Bot . 60 (12): 3311-36. DOI :10.1093/jxb/erp204 . PMID .
- Ethylene and Fruit Ripening / J Plant Growth Regul (2007) 26:143-159 doi:10.1007/s00344-007-9002-y (англ.)
- Лутова Л.А. Генетика развития растений / ред. С.Г. Инге-Вечтомов. - 2-е изд.. - Санкт-Петербург: Н-Л, 2010. - С. 432.
- . ne-postharvest.com (недоступная ссылка с 06-06-2015 )
- Neljubov D. (1901). «Uber die horizontale Nutation der Stengel von Pisum sativum und einiger anderen Pflanzen». Beih Bot Zentralbl . 10 : 128-139.
- Doubt, Sarah L. (1917). «The Response of Plants to Illuminating Gas». Botanical Gazette . 63 (3): 209-224.
Раздел очень прост в использовании. В предложенное поле достаточно ввести нужное слово, и мы вам выдадим список его значений. Хочется отметить, что наш сайт предоставляет данные из разных источников – энциклопедического, толкового, словообразовательного словарей. Также здесь можно познакомиться с примерами употребления введенного вами слова.
Значение слова этилен
этилен в словаре кроссвордиста
Толковый словарь русского языка. Д.Н. Ушаков
Толковый словарь русского языка. С.И.Ожегов, Н.Ю.Шведова.
этилен
А, м. Бесцветный газ - один из основных продуктов нефтехимической промышленности.
прил. этиленовый, -ая, -ое.
Новый толково-словообразовательный словарь русского языка, Т. Ф. Ефремова.
этилен
м. Бесцветный горючий газ, один из основных продуктов нефтехимической промышленности.
Энциклопедический словарь, 1998 г.
этилен
Н2С=СН2, бесцветный газ, tкип -103,7°С. В больших количествах (до 20%) содержится в газах нефтепереработки; входит в состав коксового газа. Один из основных продуктов нефтехимической промышленности: применяется для синтеза винилхлорида, этиленоксида, этилового спирта, полиэтилена и др.
Этилен
этен, H2C=CH2, ненасыщенный углеводород, первый член гомологического ряда олефинов, бесцветный газ со слабым эфирным запахом; tnл ≈ 169,5╟С, tkип ≈ 103,8╟С, плотность 0,570 г/см3(при tkип); практически нерастворим в воде, плохо ≈ в спирте, лучше ≈ в эфире, ацетоне. Температура воспламенения 540╟С, горит слабокоптящим пламенем, с воздухом образует взрывоопасные смеси (3
--34 объемных %). Э. весьма реакционноспособен. Наиболее характерно для него присоединение по двойной углерод-углеродной связи, например каталитическое гидрирование Э. приводит к этану:H2C = CH2 + H2 ╝ H3C≈CH3,
хлорирование ≈ к дихлорэтану:
H2C = CH2 + Cl2 ╝ ClH2C≈CH2Cl,
гипохлорирование (присоединение хлорноватистой кислоты) ≈ к этиленхлоргидрину:
H2C=CH2 + HOCl ╝ HOH2C≈CH2Cl.
Многие реакции Э. лежат в основе промышленных способов получения ряда важных продуктов; так, сернокислотной или прямой гидратацией из Э. получают этиловый спирт , каталитическим окислением ≈ этилена окись и ацетальдегид , алкилированием бензола (по Фриделя ≈ Крафтса реакции) ≈ этилбензол , полимеризацией, например в присутствии катализаторов Циглера ≈ Натта,≈ полиэтилен, окислительным хлорированием ≈ винилхлорид , сочетанием с уксусной кислотой ≈ винилацетат , присоединением HCl≈ этилхлорид , взаимодействием с хлоридами серы ≈ иприт и т. д. Основные промышленные методы получения Э.≈ высокотемпературный (700≈850╟С) пиролиз и крекинг жидких дистиллятов нефти и низших парафиновых углеводородов, главным образом этана и пропана (см. Газы нефтепереработки). Выделение и очистку Э. проводят ректификацией, дробной абсорбцией, глубоким охлаждением. В лабораторных условиях Э. можно получать дегидратацией этилового спирта, например нагреванием с серной или ортофосфорной кислотой.
Этилен в организме. Э. образуется в незначительных количествах в тканях растений и животных как промежуточный продукт обмена веществ. Содержащийся в различных органах высших растений (плодах, цветках, листьях, стеблях, корнях) Э. антагонистически взаимодействует с гормонами растений ≈ ауксинами (Э. и ауксины ингибируют биосинтез и функционирование друг друга). Сдвиг в сторону преобладающего действия Э. способствует замедлению роста, ускорению старения, созревания и опадения плодов, ускорению сбрасывания цветков или только их венчиков, завязей, листьев, а в сторону преобладающего действия ауксинов ≈ замедляет старение, созревание и опадение плодов и т. п. Пути биосинтеза Э. и его метаболизм в растительных тканях окончательно не выяснены.
Э. используют для ускорения созревания плодов (например, помидоров, дынь, апельсинов, мандаринов, лимонов, бананов), дефолиации растений, снижения предуборочного опадения плодов, для уменьшения прочности прикрепления плодов к материнским растениям, что облегчает механизированную уборку урожая. В высоких концентрациях Э. оказывает на человека и животных наркотическое действие.
Лит.: Дженсен Ю., Этилен и полиацетилены, в кн.: Биохимия растений, пер. с англ., М., 1968; Стимуляция и торможение физиологических процессов у растений, в сборнике: История и современное состояние физиологии растений, М., 1967.
Ю. В. Ракитин.
Википедия
Этилен
Этиле́н (по ИЮПАК: этен ) - органическое химическое соединение, описываемое формулой СH. Является простейшим алкеном (олефином ), изологом этана . При нормальных условиях - бесцветный горючий газ плотностью 1,178 кг/м³ со слабым запахом. Частично растворим в воде (25,6 мл в 100 мл воды при 0 °C), этаноле (359 мл в тех же условиях). Хорошо растворяется в диэтиловом эфире и углеводородах.
Содержит двойную связь и поэтому относится к ненасыщенным или непредельным углеводородам. Играет чрезвычайно важную роль в промышленности, а также является фитогормоном. Этилен - самое производимое органическое соединение в мире; общее мировое производство этилена в 2008 году составило 113 миллионов тонн и продолжает расти на 2-3 % в год. Этилен обладает наркотическим действием. Класс опасности - четвёртый.Примеры употребления слова этилен в литературе.
В том числе немало новых: окись этилена , бутан, бутилен, бутадиен, изопропилен, винилацетат, метилстирол, хинолин и крезол.
Двигатель, работающий на бензине, выбрасывает сравнительно легко окисляющиеся вещества -- этил и этилен , а газовый двигатель -- метан, который из всех предельных углеводородов наиболее устойчив к окислению.
Справа по курсу - озеро, жидкий этилен , - ровным голосом говорил в микрофон Теллур.