Пётр Гаряев. Лингвистико-волновой геном. Организация генома митохондрий. Митохондриальные болезни Горяев митохондриальный геном
Структура и функция митохондрий. Митохондрии - это цитоплазматические органеллы. Их количество и форма варьируют в зависимости от функции клетки. Например, у млекопитающих в клетках печени имеется по 1000-1500 митохондрий. Все они имеют общие структурные особенности: матрикс, внутреннюю и внешнюю мембрану (рис. 2.98). Внутренняя мембрана образует характерные складки: иногда в виде «крист», иногда в виде «трубочек». Митохондрии осуществляют важные биохимические функции, в частности, именно в них происходит аэробное окисление. Вот почему эти органеллы часто называют энергетической фабрикой организма. Энергия хранится в АТР (аденозинтрифосфат). Из трех энергетических источников нашей пищи аминокислоты и жиры подвергаются распаду только в результате аэробного окисления, которое происходит в митохондриях. Кроме того, в них осуществляется цикл лимонной кислоты. Мембрана митохондрий содержит упорядоченную мультиферментную систему, а распределение ферментов в функционально значимом порядке гарантирует упорядоченную последовательность биохимических реакций.
Подобно всему живому митохондрии размножаются путем деления. Их синтез de novo невозможен. Они содержат рибосомы, которые по размеру меньше (70S), чем рибосомы цитоплазмы (80S). Эти и другие факты привели к гипотезе, что митохондрии происходят от микроорганизмов, которые на ранних этапах эволюции вступили в симбиотические взаимоотношения с эукариотической клеткой, а затем были интегрированы, но еще сохраняют свои специфические особенности.
Геном митохондрий. Давно известно, что митохондрии имеют собственную ДНК и собственные гены, например, для транспортной РНК. С другой стороны, многие, но не все митохондриальные ферменты кодируются ядерными генами.
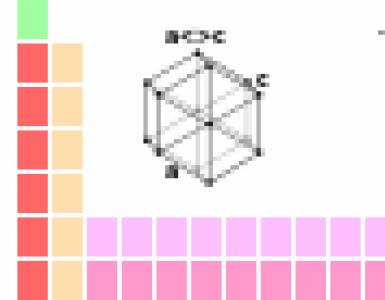
Совсем недавно в лаборатории молекулярной биологии Медицинского исследовательского центра в Кэмбридже была полностью расшифрована последовательность ДНК и выяснена организация генов в митохондриальном геноме человека (, рис. 2.99). Оказалось, что геном митохондрий представлен кольцевой молекулой ДНК, содержащей 16 569 нуклеотидных пар. В состав генома входят гены 12S- и 16S-pPHK, 22 различных тРНК, субъединиц I, II и IIIоксидазы цитохрома с, субъединицы 6 АТРазы, цитохрома b и девяти других пока неизвестных белков. В про-
2. Хромосомы человека 147
тивоположность ядерному геному (разд. 2.3.1.1) нуклеотидная последовательность митохондрий характеризуется весьма экономной организацией: в ней нет или имеется очень мало некодирующих участков. Кроме того, в митохондриальной ДНК транскрибируются и транслируются обе цепи. Во многих случаях триплет, определяющий терминацию транскрипции, не закодирован в ДНК, а создается посттранскрипционно. И наконец, по ряду характеристик генетический код митохондриальной ДНК человека отличается от универсального: UGA кодирует триптофан, а не терминацию транскрипции, AUA кодирует метионин, а не изолейцин, AGA и AGG являются стоп-кодонами, а аргинин не кодируют. Существенно также, что в третьей позиции кодонов, которая является основным источником вырожденности кода, А или С (по сравнению с G или Т) встречаются чаще, чем в ядерном геноме.
Полиморфизм ДНК и наследственные болезни, связанные с митохондриальными мутациями. Расшифровка нуклеотидной последовательности митохондриального генома человека ускорила выявление в нем полиморфных сайтов рестрикции (разд. 2.3.2.7, см. разд. 6.1). Бланк и соавт. для анализа ДНК использовали 12 рестриктаз. В группу испытуемых входило 112 человек, принадлежащих разным расовым группам. Скринировали суммарно 441 сайт рестрикции. Из всех исследованных сайтов 163 оказались полиморфными, т.е. присутствовали у одних и отсутствовали у других индивидов. Остальные 278 сайтов оказались константными. Полиморфизм наблюдали во всех частях генома. Кроме того, обнаружены расовые различия в отношении частоты ряда полиморфных вариантов .
До настоящего времени генетическая рекомбинация митохондриальной ДНК человека не обнаружена; если она и происходит, то, вероятно, очень редко. Следовательно, рестрикционный полиморфизм митохондриальной ДНК в популяции отражает картину ее мутационной истории. Это означает, что, сравнивая популяции по полиморфизму этого типа, можно определить их происхождение и историю много точнее, чем на основе анализа полиморфизма классического типа (разд. 6.2.3).
Рис. 2.99.Митохондриальный геном человека представляет собой двухцепочечное кольцо. Цепи отличаются по их плотности в градиенте CsCl: тяжелая (Н) и легкая (L). Стрелки показывают направление транскрипции. Начало стрелок совпадает с сайтом промотора. Участки, обозначенные жирной линией, содержат идентифицированные гены двух молекул рРНК; гены CoI, CoII и СоIII для субъединиц оксидазы цитохрома с; для субъединицы 6 АТР-синтазы и для цитохрома b, Гены тРНК для различных аминокислот обозначены точками. L-цепь содержит 8 генов тРНК. Пустые участки, вероятно, кодируют еще неидентифицированные гены. (По Kuppers, Molekulare Genetik, 4th ed., 1985.)Большое количество митохондрий содержится в ооцитах, тогда как в спермин их только четыре. При оплодотворении эти митохондрии не попадают в ооцит. Следовательно, все митохондрии во всех клетках любого индивида имеют материнское происхождение . В связи с этим возникает вопрос, может ли мутация в митохондриальной ДНК быть причиной наследственного заболевания. Такая патология должна передаваться только от матери всем ее детям (разд. 3.15).
Представляется, что такой тип наследо-
148 2. Хромосомы человека
вания маловероятен, ведь каждый ооцит содержит множество митохондрий, и если в одной из них произошла мутация, все остальные остаются немутантными и, следовательно, не должно быть никакого фенотипического эффекта. С другой стороны, такой же аргумент справедлив и в отношении рестрикционного полиморфизма митохондриальной ДНК. Однако полиморфизм этого типа наследуется всеми детьми от матери, причем все митохондрии одного индивида генетически однородны. Какова причина этого пока непонятного явления? Может быть, все митохондрии ооцита являются потомками одной стволовой митохондрии?
Геном митохондрий человека представлен кольцевой двухцелочечной молекулой ДНК, содержащей 16559 п.н. Доля митохондриальной ДНК от общего количества ДНК достигает 5%. Митохондриальная молекула ДНК состоит из тяжелой (Н) и легкой (L) - цепей. Цепи различаются по нуклеотидному составу. Н-цепь (heavy) содержит больше пурина, легкая L-цепь (ligbt) - больше пиримидина. Митохондриальный геном человека, как и других организмов, представляет собой полуавтономную генетическую систему. Большая часть генов человека локализована в хромосомах ядра, и меньшая - в митохондриальном геноме. 1987г-Адан Уилсон исследовал ДНК 147 представителей различных расс(женщин). Анализ показал, что все мтДНК можно представить как происходящие от одной предковой. Общаа праматерь, к которой восходят все типы мтДНК современных людей, жила в Восточной Африке менее 200тыс лет назад. Митохондрии - это внутриклеточные органеллы, имеющие небольшую собственную хромосому. В отличие от ядерной ДНК, которая содержит подавляющее большинство генов и в процессе полового размножения подвергается рекомбинации, так что потомки получают половину генов от отца, а вторую половину от матери, митохондрии и их ДНК ребёнок получает только из материнской яйцеклетки. Поскольку митохондриальная ДНК не подвергается рекомбинации, изменения в ней могут происходить исключительно посредством редких случайных мутаций. Митохондриа́льные заболева́ния - группа наследственных заболеваний, связанных с дефектами в функционировании митохондрий, приводящими к нарушениям энергетических функций в клетках эукариотов, в частности - человека. Митохондриальные заболевания обусловлены генетическими, структурными, биохимическими дефектами митохондрий, приводящими к нарушениям тканевого дыхания. Они передаются только по женской линии к детям обоих полов, так как сперматозоиды передают зиготе половину ядерного генома, а яйцеклетка поставляет и вторую половину генома, и митохондрии. Патологические нарушения клеточного энергетического обмена могут проявляться в виде дефектов различных звеньев в цикле Кребса, в дыхательной цепи, процессах бета-окисления и т. д. Эффекты митоходриальных заболеваний очень разнообразны. Из-за различного распределения дефектных митохондрий в разных органах, мутация у одного человека может привести к заболеванию печени, а у другого - к заболеванию мозга. Величина проявления дефекта может быть большой или малой, и она может существенно изменяться, медленно нарастая во времени. Некоторые небольшие дефекты приводят лишь к неспособности пациента выдерживать физическую нагрузку, соответствующую его возрасту, и не сопровождаются серьёзными болезненными проявлениями. Другие дефекты могут быть более опасны, приводя к серьёзной патологии.В общем случае, митоходриальные заболевания проявляются сильнее при локализации дефектных митохондрий в мышцах, мозге, нервной ткани, поскольку эти органы требуют больше всего энергии для выполнения соответствующих функций. Для постановки диагноза митохондриального заболевания важен комплексный генеалогический, клинический, биохимический, морфологический и генетический анализ
|
Наталия Васильевна Сернова — кандидат физико-математических наук, магистр протеомики и биоинформатики Женевского университета. Научные интересы: биоинформатика, регуляция транскрипции, сравнительная геномика, эволюция млекопитающих. |
Михаил Сергеевич Гельфанд — доктор биологических наук, член Европейской академии, заместитель директора Института проблем передачи информации им. А. А. Харкевича РАН, профессор факультета биоинженерии и биоинформатики Московского государственного университета им. М. В. Ломоносова. Область научных интересов — биоинформатика, сравнительная и функциональная геномика, молекулярная эволюция, системная биология, метагеномика. |
Практически во всех клетках эукариот есть митохондрии - органеллы, которые нужны в первую очередь для синтеза АТФ. История симбиоза бактерий, родственных риккетсиям, и предка эукариот, в результате которого возникли митохондрии, очень интересна, однако здесь речь пойдет не о ней. Для нас сейчас будет важно лишь то, что у митохондрий есть свой собственный геном (у млекопитающих его размер 15–20 тыс. пар нуклеотидов), что у животных он передается строго по материнской линии и что в каждой клетке присутствуют десятки и даже тысячи митохондрий, а стало быть, в любом образце количество копий митохондриального генома на несколько порядков превышает число копий любого фрагмента ядерного генома. Это особенно существенно при анализе древних образцов, в которых сохранилось мало неповрежденной ДНК.
Мы будем обсуждать интрогрессию митохондриальных геномов. Интрогрессия - это форма гибридизации, при которой гены одного вида проникают в генофонд другого. В результате образуются гибриды первого поколения, способные к возвратному скрещиванию с одним или обоими родительскими видами. Если возвратное скрещивание происходит многократно в последовательных поколениях, то может возникнуть поток вариантов некоторых генов от одного вида к другому. Такой прием часто используется в селекции, когда требуется передать некий признак от одного вида другому, например устойчивость к болезням от дикого вида к культурному сорту: производят многократные возвратные скрещивания с культурным сортом, а отбор ведут по данному признаку. Постепенно в большинстве локусов остаются только аллели культурного сорта, а локусы, от которых зависит желаемый признак, наследуются от дикого вида - и в результате получается новый устойчивый сорт.
Однако интрогрессия может происходить и в результате естественной гибридизации. Известно, что межвидовая гибридизация характерна для 10% видов животных, в частности для 6% видов млекопитающих . Если все потомки родителей, принадлежащих к разным видам, далее скрещиваются с представителями только одного из них, причем многократно в ряде последовательных поколений, то возникает однонаправленный поток вариантов генов от вида, который представляет собой донора, в популяционную систему, служащую реципиентом. Таким образом, интрогрессия - это такая гибридизация, при которой поток генов и рекомбинация доходят до видового уровня. При этом из-за упомянутых особенностей наследования митохондриального генома у животных и из-за отсутствия рекомбинации их митохондриальной ДНК оказывается легко следить за интрогрессией именно митохондриальных генов. Особый интерес представляет так называемый митохондриальный захват, когда в какой-либо популяции все митохондриальные геномы происходят от одного вида, а все ядерные - от другого. Следует отметить, что это довольно строгое определение: никогда нельзя гарантировать, что в геноме гибридов не сохранилось фрагмента ядерного генома второго вида хотя бы у части особей, поскольку для этого надо проводить подробное генотипирование большого числа ядерных геномов, что долго и дорого.
Интрогрессия митохондриальных геномов ведет к тому, что филогении, построенные по митохондриальным и ядерным маркерам, оказываются несогласованными. В недавнем обзоре обобщили 126 случаев полной и неполной митохондриальной интрогрессии у животных. Большинство из этих случаев описано уже в XXI веке. Причины интрогрессии могут быть разными: селективное преимущество, демографические особенности, смещение зоны гибридизации, влияние человека, у насекомых - заражение вольбахией и разнообразные связанные с этим эффекты, например искажение соотношения полов. Чаще всего, по-видимому, действует комбинация причин. Особый интерес представляют случаи полной интрогрессии, когда на всем ареале подавляющее большинство особей имеет митохондрии, геномы которых практически совпадают с митохондриальными геномами другого вида. Такого не замечали у земноводных, зато наблюдали четыре подобных случая у птиц, пять - у рыб и два - у насекомых. Четыре случая было отмечено у млекопитающих: митохондриальный геном тара (Hemitragus jemlahicus ) у предка диких европейских коз Capra spp. , белохвостого оленя (Odocoileus virginianus ) у чернохвостого (O. hemionus ) в Северной Америке , расы Carlit обыкновенной землеройки, или бурозубки (Sorex araneus ), у иберийской (S. granarius ) и, наконец, бурого медведя (Ursus arctos ) у белого (U. maritimus ) . О медведях речь пойдет ниже, а сначала обсудим слонов.
Африканские слоны: один или два вида?
По морфологическим особенностям африканские слоны делятся на две группы: саванные (Loxodonta africana ), которые живут в сухой саванне, и лесные (L. cyclotis ), которые обитают во влажных лесах. Вопрос о статусе этих групп до сих пор остается открытым. Некоторые авторы считают эти группы подвидами , в то время как другие относят их к разным видам [8–13 ] . Расхождение лесных и саванных слонов произошло от 2,5 млн лет назад (по ядерной ДНК) до 5,5 млн лет назад (по митохондриальной ДНК) .
Ареалы этих двух групп не разделены, и существует обширная зона контакта, на которой возможна гибридизация. В ряде популяций, например, в регионе Серенгети в Восточной Африке, большинство саванных слонов имеют митохондриальный геном лесных . Это объясняют межвидовыми скрещиваниями лесных самок с саванными самцами с последующей интрогрессией. Возможный сценарий, который учитывает хорошо изученные особенности социального поведения африканских слонов , выглядит следующим образом [8–10 ].
Слоны живут большими стадами - до нескольких десятков особей. Стадо включает только самок разного возраста и их неполовозрелое потомство и возглавляется старшей самкой-матриархом. Все слоны в стаде родственны по материнской линии и имеют одинаковый митохондриальный геном. Самцы слонов, достигшие половой зрелости (12 лет), изгоняются из стада. Они тоже могут объединяться в группы, которые состоят из самцов разного возраста и где главенствуют крупные пожилые самцы.
Когда самка достигает репродуктивного возраста (10–12 лет) и у нее начинается эстральный цикл, она уходит из стада на период до нескольких недель для встречи с самцом. Затем возвращается в материнское стадо и через 22 месяца рожает детеныша, которого выкармливает около двух лет, т.е. в течение почти четырех лет самка репродуктивного возраста не готова к новому контакту. Для спаривания самки предпочитают крупных самцов.
Рассредоточение слонов по группам не приводит к полному разделению родственников мужского и женского пола, поэтому слоны способны распознавать сородичей. Учитывая, что саванные самцы предпочитают избегать инбридинга и что они крупнее лесных слонов и репродуктивно над ними доминируют, а эстральные самки встречаются редко, не исключено, что в таких условиях лесные самки заполняют освободившуюся нишу и составляют конкуренцию саванным самкам. Здесь уместно вспомнить, что корреляция между внутривидовым потоком генов и межвидовым отрицательна .
После спаривания с саванным самцом лесная самка возвращается в материнское стадо лесных слонов. Через 22 месяца на свет появляется гибрид с митохондриальным геномом лесных слонов и ядерной ДНК саванных и лесных слонов поровну. Гибридная самка начнет передавать митохондриальный геном следующим поколениям по материнской линии. Каждое возвратное скрещивание лесных или гибридных самок с саванными самцами будет уменьшать долю ядерной ДНК лесного слона наполовину. И через много поколений у гибридов ядерная ДНК саванного слона полностью заменит ядерную ДНК лесного слона. К тому же саванные самцы почти вдвое крупнее лесных, а значит, пользуются преимуществом при спаривании в том числе и с лесными и гибридными самками. Кроме того, гибридные самцы могут обладать пониженной плодовитостью согласно правилу Холдейна: если при скрещивании разных подвидов или рас жизнеспособность потомства зависит от пола, более редким (или вообще отсутствующим) будет гетерогаметный пол, то есть у млекопитающих - самцы .
Эта модель хорошо объясняет, почему в областях, далеких от зоны контакта двух групп, практически нет ни слонов с промежуточной морфологией, ни особей со смешанным - саванным с лесным - ядерным геномом, в том числе среди саванных слонов с митохондриальным геномом лесного типа. Однако она наталкивается на противоречие: поскольку самки слона возвращаются в материнское стадо, гибридные самки оказываются в стаде с лесными, а значит, не могут передать свою митохондриальную ДНК саванным слонам. Тем более не могут этого сделать гибридные самцы, ведь митохондриальный геном наследуется только по материнской линии.
Возможно, этот парадокс объясняется изменениями популяционной структуры и ареала слонов под влиянием климатических изменений и деятельности человека - хозяйственной и охоты, в том числе браконьерской. Есть наблюдения, что, когда численность натального стада у саванных слонов по тем или иным причинам падает, матриарх может принимать самок из других, неродственных, групп . Так, например, в Уганде, где популяции слонов существенно сократились из-за браконьерства, самки с разными митохондриальными гаплотипами сформировали новые социальные группы . Кроме того, раз гибридные самки имеют ядерную ДНК саванного слона, они могут быть морфологически близки к саванным сородичам, а потому их не изгоняют из стада, когда они оказываются в зоне симпатрии.
Однако недавний подробный анализ четырех популяций слонов из контактных зон показал более сложную картину (рис. 1). Среди гибридных особей ни одна не оказалась гибридом первого поколения. Это доказывает, что гибриды саванных и лесных слонов фертильны. Однако, когда построили филогенетические деревья по маркерам митохондрий (строго материнское наследование) и Y-хромосом (строго отцовское), стало очевидно, что гибридизация шла в обоих направлениях: геномы и саванных, и лесных слонов образовали по две четко выделенные ветви, так что геномы гибридных особей могли принадлежать и одной, и другой.
Тем не менее все авторы последних исследований склонны считать лесных и саванных слонов разными видами [ , ]. По мнению Эрнста Майра, гибридизация в зоне контакта необязательно означает, что мы имеем дело с одним видом - гибридами. Генетическая цельность двух видов вполне может сохраняться . В случае африканских слонов это и наблюдается: вдали от зоны контакта нет никаких следов смешения, кроме митохондриальной интрогрессии, а морфологически виды, несмотря на нее, различны.
Бурые и белые медведи: один или два вида?
Ответ кажется очевидным. Конечно, два - достаточно сходить в зоопарк и посмотреть. Однако...

Ученые из Института арктической биологии Университета Аляски исследовали популяцию бурых медведей с архипелага Александра у берегов Аляски (с островов Адмиралти, Баранова и Чичагова, которые по первым латинским буквам называют островами АВС; рис. 2). В 1996 г. они заметили, что митохондриальные геномы этих медведей больше похожи на митохондриальные геномы белых медведей (Ursus maritimus ), чем бурых (U. arctos ) из других популяций . Несколько гипотез пытались это объяснить: происхождением белых медведей из древней прибрежной популяции бурых, которая сохранилась только на островах АВС , интрогрессией митохондриальных генов бурых медведей с островов АВС в геном белых и, наоборот, интрогрессией митохондриальных генов белых медведей в геном бурых [ , ]. Предположение, что белые медведи недавно произошли от бурых, казалось бы, подтвердилось, когда секвенировали митохондриальный геном древнего (130–110 тыс. лет назад) белого медведя из челюстной кости, найденной на архипелаге Шпицберген . Оказалось, этот геном очень близок к точке ответвления митохондриальных геномов современных белых медведей и ближайших к ним бурых медведей с островов ABC.
Получается, белые медведи - это не отдельный вид, а ветвь бурых медведей, которая отделилась сравнительно недавно, не более 150 тыс. лет назад, и сильно изменилась морфологически? Более обширный анализ митохондриальных геномов указывает на еще более фантастический сценарий. Действительно, митохондриальные геномы древних белых медведей из Скандинавии ближе всего к геномам медведей с островов АВС. В то же время митохондриальные геномы современных белых медведей существенно ближе к геномам вымершей ветви бурых медведей из Ирландии - расхождение этих двух линий произошло менее 40 тыс. лет назад (рис. 3). Следует отметить, что эти же данные интерпретировали заново уже иначе - как интрогрессию митохондриальных генов белого медведя в геном бурого . Правда, это не объясняет, почему эта ветка находится в глубине большой клады бурых медведей.
Анализ же ядерных геномов показывает, что белые медведи разделились с бурыми примерно 600 тыс. лет назад (рис. 4). Согласно этой работе, в ядерных геномах не наблюдается следов (недавних) гибридизаций между белыми и бурыми медведями, однако согласно другим исследованиям 5–10% ядерного генома бурых медведей с островов АВС происходят из генома белого медведя, а расхождение видов отнесено на 4 млн лет назад . Вообще, имеет смысл отметить важное последствие гибридизации, которое, однако, существенно затрудняет датировки: она ведет к тому, что различные геномные локусы имеют разную историю. Так, еще в одной работе расхождение бурых и белых медведей датируется примерно 400 тыс. лет назад, хотя также отмечен существенный поток генов белого медведя в геном медведей с островов АВС. Наконец, следует заметить, что во многих работах отмечается меньшая эффективная численность популяции белых медведей по сравнению с бурыми и эффект бутылочного горлышка - эпизоды резкого сокращения численности популяции после разделения с бурыми [ , , ]. Расхождение Y-хромосом белого и бурого медведя, для которых не заметно признаков интрогрессии, датируется приблизительно 1,1 млн лет назад (рис. 5). Вопрос о потоке ядерных генов бурого медведя в геном белого остается противоречивым: отмечались как следы слабого потока , так и полное его отсутствие . При этом поток генов белого медведя шел и в геномы материковых бурых медведей с Аляски, хотя и был слабее . Полный список оценок дан в обзоре .
Положительный отбор в геномах белых медведей затронул гены, связанные с формированием жировой ткани, развитием сердечной мышцы и свертываемостью крови, а также пигментацией меха . В то время как интрогрессии в геном бурого медведя подвергся ген ALDH7A1 , который регулирует осмотический стресс: это могло иметь приспособительное значение для прибрежной (островной) популяции бурых медведей .
Один из главных, принципиальных открытых вопросов, который слабо обсуждается в литературе, - произошло ли полное закрепление интрогрессировавших митохондриальных генов бурого медведя во всей популяции белых медведей под действием отбора или же в силу случайного дрейфа. Второй вопрос - была ли первоначально популяция бурых медведей с островов АВС популяцией белых медведей с почти тотальной интрогрессией ядерных генов бурых медведей за счет самцов, приплывавших с материка , или же популяцией бурых медведей, в геном которой интрогрессировали митохондриальные гены белых медведей в результате одной или нескольких гибридизаций с самками белого медведя.
Ко второму вопросу стоит добавить, что географическое распределение митохондриальных гаплотипов и белых медведей, и бурых высоко структурировано, что отражает привязанность самок к месту рождения, тогда как гаплотипы Y-хромосомы перемешаны из-за частых миграций самцов . С одной стороны, это косвенно свидетельствует о том, что случайный дрейф митохондриального генома должен быть затруднен. С другой стороны, его могли облегчать колебания численности и эффект бутылочного горлышка.
Хотя основные факты - полную интрогрессию митохондриальных генов бурого медведя в геном белого (возможно, неоднократную), значительный поток ядерных генов белого медведя в геном бурых медведей с островов АВС (и возможно, с Аляски), значительные колебания численности белых медведей - по-видимому, в целом можно считать твердо установленными, детали этой эволюционной истории нуждаются в прояснении. Как и всегда, нужно больше геномов - и современных, из разных популяций, и древних.
И снова люди
Пожалуй, одна из основных загадок геномной эволюции древних людей - происхождение денисовцев. Мы уже писали об этом вопросе в предыдущих статьях [ , ], однако полезно вернуться к нему именно в контексте обсуждаемых здесь несовпадений истории ядерных и митохондриальных геномов.
Денисовцы по ядерному геному - сестринская группа с неандертальцами, однако разошлись с ними вскоре после отделения от кроманьонцев. Оценки неточны, но в первом приближении разделение кроманьонцев и денисовцев + неандертальцев произошло примерно 650 тыс. лет назад, а денисовцев и неандертальцев - около 450 тыс. лет назад. Нам известен один ядерный геном из Денисовой пещеры на Алтае (возраст - примерно 50 тыс. лет) и несколько митохондриальных геномов оттуда же, самый старый из которых датируется 110 тыс. лет назад. Кроме того, известны фрагменты денисовского генома, которые сохранились в геномах австранезийцев. Денисовский вариант гена EPAS1 практически зафиксировался в популяции тибетцев. Все это указывает на обширность ареала денисовцев.
А вот по митохондриальному геному денисовцы разделились с ветвью неандертальцев + кроманьонцев около миллиона лет назад. Этот геном ближе всего к митохондриальному геному человека возрастом около 430 тыс. лет из пещеры Сима де лос Уэсос в Испании. Однако получается парадокс: ядерный геном из пещеры Сима де лос Уэсос ближе к неандертальскому, чем к денисовскому (авторы оригинальной статьи не приводят оценок времени расхождения). Таким образом, нет никакого простого сценария, который бы включал лишь интрогрессию, чтобы объяснить эти наблюдения. Авторы предполагают, что митохондриальные геномы из Денисовой пещеры и Сима де лос Уэсос - прямые потомки геномов древнего выходца из Африки, предка неандертальцев и денисовцев, кем бы он ни был с антропологической точки зрения, а митохондриальные геномы неандертальцев - результат поздней интрогрессии африканского же происхождения. В пользу этой гипотезы говорит то, что в геноме алтайского неандертальца обнаружены кроманьонские фрагменты, причем это следы гибридизации, предшествовавшей выходу из Африки предка современных европейцев и азиатов . Однако такие фрагменты отсутствуют в геномах других неандертальцев, в то время как митохондриальные геномы всех неандертальцев очевидно образуют единую ветвь на филогенетическом дереве. Кроме того, возникают проблемы с датировкой: носитель кроманьонских фрагментов в геноме алтайского неандертальца отделился от остальных кроманьонцев примерно 250 тыс. лет назад (до начала разделения современных популяций в Африке), а разделение митохондриальных ветвей кроманьонцев и неандертальцев датируется примерно 500 тыс. лет назад. Получается, это не могло быть результатом одного события. Альтернативное объяснение состоит в том, что источник митохондриальной ДНК денисовцев и человека из пещеры Сима де лос Уэсос - неизвестные представители рода Homo (H. erectus ?). Однако оно также не дает простого ответа на вопрос, где, когда и с кем произошла эта гибридизация.
Удивительно не то, что мы не знаем ответов на многие вопросы. Удивительно то, что мы можем эти вопросы задавать и надеемся получить на них ответы.
Н. В. Сернова благодарна своей маме Наталии Владимировне Серновой за вдохновение и помощь. М. С. Гельфанд благодарен фонду «Эволюция» за поддержку научно-популярных лекций, подготовка к которым помогла лучше осознать изложенный материал.
Работа выполнена при поддержке Российского научного фонда (проект 14-24-00155).
Литература
.
Mallet J. Hybridization as an invasion of the genome // Trends Ecol. Evol.
2005. V. 20. P. 229–237.
.
Toews D. P. L., Brelsford A. The biogeography of mitochondrial and nuclear discordance in animals // Mol. Ecol.
2012. V. 21. P. 3907–3930.
.
Ropiquet A., Hassanin A. Hybrid origin of the Pliocene ancestor of wild goats // Mol. Phylogenet. Evol.
2006. V. 41. P. 395–404.
.
Cathey J. C., Bickham J. W., Patton J. C. Introgressive hybridization and nonconcordant evolutionary history of maternal and paternal lineages in North American deer // Evolution
. 1998. V. 52. P. 1224–1229.
.
Yannic G., Dubey S., Hausser J. et al. Additional data for nuclear DNA give new insights into the phylogenetic position of Sorex granarius
within the Sorex araneus
group // Mol. Phylogenet. Evol.
2010. V. 57. P. 1062–1071.
.
Edwards C. J., Suchard M. A., Lemey P. et al. Ancient hybridization and an Irish origin for the modern polar bear matriline // Curr. Biol.
2011. V. 21. P. 1251–1258.
.
Debruyne R. A case study of apparent conflict between molecular phylogenies: the interrelationships of African elephants // Cladistics
. 2005. V. 21. P. 31–50.
.
Cyto-nuclear genomic dissociation and the African elephant species question // Quat. Int.
2007. V. 169–170. P. 4–16.
.
Roca A. L., Ishida Y., Brandt A. L. et al. Elephant natural history: a genomic perspective // Annu. Rev. Anim. Biosci.
2015. V. 3. P. 139–167.
.
Roca A. L., Georgiadis N., O’Brien S. J. Cytonuclear genomic dissociation in African elephant species // Nat. Genet.
2005. V. 37. P. 96–100.
.
Grubb P., Groves C. P., Dudley J. P. et al. Living African elephants belong to two species: Loxodonta africana
(Blumenbach, 1797) and Loxodonta cyclotis
(Matschie, 1900) // Elephant
. 2000. V. 2. P. 1–4.
П.П.Гаряев
ЛИНГВИСТИКО-ВОЛНОВОЙ ГЕНОМ. ТЕОРИЯ И ПРАКТИКА.
(201 стр., 32 рисунка, 4 таблицы, 12 графиков, 36 фотографий)
Московский Государственный Технический Университет им. Н.Э.Баумана
Институт Квантовой Генетики
В книге д.б.н., акад. РАМТН и РАЕН П.П.Гаряева «Волновой геном. Теория и практика» затронуты фундаментальные вопросы генетического кода, которые связаны со структурой, функционированием. Понятно, что мы еще далеки от полного решения всех вопросов генетического кода, но идеи проф. Гаряева П.П. и его коллег дают возможность увидеть нечто совершенно новое в работе хромосомного аппарата живых клеток. Видится принципиально новое научно-практическое направление, которое можно было бы назвать «генетико-волновая навигация и управление в биосистемах». Оно подано автором в рамках теоретических моделей, подтверждаемых собственными и независимыми экспериментальными исследованиями. Квантовая составляющая генетической работы клеток представляется чрезвычайно важной. Ясно, что гигантским по масштабам и сложности метаболизмом клеток, тканей и организма в целом необходимо управлять. В связи с этим автор выдвигает новую и существенную идею генетического квантового биокомпьютинга. Такой подход интересен и для опторадиоэлектроники, радиотехники, компьютинга, систем навигации и управления. Более того, волновые механизмы работы клеток имеют прямое отношение к наноэлектронике. Живые организмы наглядно показывают нам примеры нанобиотехнологий, эффективно используя для собственной волновой биокомпьютерной регуляции такие активно работающие наноструктуры как ферменты, рибосомы, митохондрии, мембраны, цитоскелет и хромосомы. Нанотехнические механизмы работы клеток и их генетического аппарата нуждаются в теоретико-биологическом осмыслении и физико-математическом анализе, который позволяет создать, в том числе, неизвестные ранее принципиально новые лазерно-радиоволновые технологии генетического управления метаболизмом многоклеточных организмов. Результаты использования таких технологий коллективом П.П.Гаряева впечатляют. Авторами корректно и развернуто продемонстрирована дальняя (многокилометровая) волновая передача реальной управляющей генетической информации от Донора (живой ткани) к Реципиенту (организму). Такая передача до недавнего времени считалась принципиально невозможной. Теперь это фундаментальный факт. Появляется возможность создания совершенной уникальной молекулярно-оптико-радиоэлектронной аппаратуры, которая сможет осуществлять сложнейшие навигационно-регуляторные функции для позитивного управления генетико-физиологическими функциями организмов. Рассматривается проблема по созданию генетического лазера. Факт лазерной накачки ДНК и хромосом ‘in vitro’ акад. П.П.Гаряевым и его коллегами уже продемонстрирован и опубликован в 1996 г. и подтвержден работами японских исследователей в 2002 г. Такой лазер будет выполнять многие, ранее непонятные функции генетического аппарата для решения проблем биологии, медицины и сельского хозяйства. Другая сторона такой работы – это возможность применения когерентных состояний и излучений живых клеток и их информационных структур для проектирования биокомпьютеров, работающих на принципах голографии, солитоники и квантовой нелокальности. Фактически прообраз такого биокомпьютера создан коллективом П. Гаряева, что и позволило получить уникальные результаты по квантовой трансляции генов и дальнему волновому генетическому управлению. Использование хромосомных лазеров и биокомпьютеров не ограничивается сказанным и распространяется шире за пределы биосистем – на космическую связь, управление сверхсложными техническим процессами, авиационную навигацию и т.д. В работе выделяется ряд нерешенных задач, в том числе исследование волновых реплик ДНК и лазерно-радиоволновых процессов, имеющими место при снятии и передаче квантовой биоинформации от Донора к Реципиенту. Считаю, что выход в свет монографии П.П. Гаряева будет способствовать дальнейшему процессу дознания одной из божественных загадок – загадок генетического кода и приведет к применению новых идей на благо человечества.
В.А. Матвеев
Доктор технических наук,
Профессор МГТУ им. Н.Э. Баумана,
Декан факультета «Информатика и системы управления»,
Заслуженный деятель науки РФ,
Лауреат премий Правительства РФ и города Москвы
Скачать книгу можно тут.
Вы знаете, что антропологи подразделяют людей на три большие расы: негроиды, европеоиды и монголоиды. Представители этих рас отличаются цветом кожи, формой тела, разрезом глаз и т.д. Но на самом деле четкие различия между разными людьми, относящимся к разным расам, имеются только если мы возьмем географически отдаленные группы. Если посмотреть на все разнообразие антропометрических признаков в целом, то окажется, что четких различий нет, существует множество переходных форм. Почему и как у людей сформировались внешние различия, где и когда зародилось человечество?
Рисунки к статье созданы на основе данных лаборатории анализа генома ИОГен РАН и следующих публикаций:
- Степанов В.А. Этногеномика народов Северной Евразии. Томск, 2002.
- Stephen Oppenheimer. The Real Eve: modern man"s journey out of Africa www.bradshawfoundation.com/journey/
- Ovchinnikov IV, G?therstr?m A, Romanova GP, Kharitonov VM, Lid?n K, Goodwin W.Molecular analysis of Neanderthal DNA from the northern Caucasus.// Nature. 2000 30;404(6777):490-3.
- Tishkoff SA, Williams SM. Genetic analysis of African populations: human evolution and complex disease. //Nat Rev Genet. 2002;3(8):611-21.